
官方微信

發(fā)布時(shí)間:2018-01-22 點擊數: 14991 次
SOP制定記錄表
SOP題目:藥物臨床試驗倫理審查申請标準規範流程
SOP編号: SOP-IEC-025-01 頁數:10頁
Ⅰ、目的
為保護臨床研究中受試者的權益、保障其安全,保證臨床研究的科學(xué)性,為幫助開(kāi)展的研究者提交倫理審查,特制定本指南。
Ⅱ、範圍
本指南适用于我院倫理委員會(huì)日常工作。
Ⅲ、依據
《藥物臨床試驗質量管理規範》(修訂稿)
《藥物臨床試驗倫理審查工作指導原則》(2010年版)
Ⅳ、規程
1. 提交倫理審查的研究項目範圍
根據國(guó)家食品藥品監督管理總局“藥物臨床試驗質量管理規範”(2003年),“藥物臨床試驗倫理審查工作指導原則”(2010年),國(guó)家衛生和計劃生育委員會(huì)“涉及人的生物醫學(xué)研究倫理審查辦法(試行)”(2016年),下列範圍的研究項目應依據本指南提交倫理審查報告:
2. 倫理審查申請/報告的類别
2.1. 初始審查
初始審查申請:符合上述範圍的臨床試驗項目,應在研究開(kāi)始前提交倫理審查申請,經(jīng)批準後(hòu)方可實施。“初始審查申請”是指首次向(xiàng)倫理委員會(huì)提交的審查申請。
申請者須填寫“大同和平醫院有限公司藥物臨床試驗倫理審查申請表”(簽名并注明日期),并提供以下書面(miàn)材料(有申辦者原章,超過(guò)兩(liǎng)頁以上的文檔雙面(miàn)打印),供倫理委員會(huì)審核及備案。
藥物臨床試驗研究方案初次申請審查,應提交的文件:
以下材料請準備一份原件
(1)遞交信(含所遞交文件清單,注明所有遞交文件的版本号或日期);
(2)倫理審查申請表(藥物)(務必填寫完整,由主要研究者簽字);
以下材料可按倫理委員會(huì)參會(huì)委員人數準備,可複印
(1). 國(guó)家食品藥品監督管理局臨床試驗批件或注冊批件;
(2). 牽頭單位倫理委員會(huì)批件;
(3). 臨床試驗藥品及對(duì)照藥品合格檢驗報告;
(4). 申辦者資質證明及臨床試驗藥品生産的GMP證書複印件;
(5). 研究方案(含方案編号,版本号和日期);
(6). 知情同意書(含方案編号,版本号和日期);
(7). 研究者手冊(版本号和日期,IV期須提供藥物說(shuō)明書);
(8). 病例報告表(含方案編号,版本号和日期);
(9). 主要研究者簡曆;
(10). 多中心研究單位一覽表;
(11). 申辦者委托函;
(12). 其他資料(如受試者須知、受試者日記、緊急聯系卡、招募廣告、保險聲明等)。
備注:(5)、(6)、(7)、(8)如有中英文版,請提供中文版,送審材料裝訂盡量簡潔,材料區分盡量有隔開(kāi)标志)
2.2. 跟蹤審查
2.2.1. 修正案審查:
研究過(guò)程中若變更主要研究者,對(duì)臨床研究方案、知情同意書、招募材料等的任何修改,應向(xiàng)倫理委員會(huì)提交修正案審查申請,經(jīng)批準後(hòu)執行。為避免研究對(duì)受試者的即刻危險,研究者可在倫理委員會(huì)批準前修改研究方案,事(shì)後(hòu)應將(jiāng)修改研究方案的情況及原因,以“修正案審查申請”的方式及時(shí)提交倫理委員會(huì)審查。
請提供以下書面(miàn)材料兩(liǎng)份(有申辦者原章,超過(guò)兩(liǎng)頁以上的文檔雙面(miàn)打印),供倫理委員會(huì)辦公室審核及備案。
1)研究方案和/或知情同意書更新應包括:
(1). 遞交信(含遞交文件清單、注明版本号和日期)
(2). 修正方案倫理審查申請表
(3). 對(duì)研究方案或其他相關文件做修正的說(shuō)明(注明修改處在修改前的頁碼、行數及修改後(hòu)的内容)
(4). 修正版研究方案及相關文件(含方案編号、版本号和日期,所作更改處必須劃線或熒光塗色标示)
(5). 中心倫理批件
2)研究方案按委員會(huì)初次審查意見修改後(hòu)申請複審時(shí)應包括:
(1). 再次送審遞交信(含遞交文件清單、注明版本号和日期)
(2). 再次審查工作表
(3). 對(duì)研究方案或其他相關文件做修改的說(shuō)明(注明修改處在修改前的頁碼、行數及修改後(hòu)的内容)
(4). 修正版研究方案及相關文件(含方案編号、版本号和日期,所作更改處必須劃線或熒光塗色标示)
3)報告嚴重不良事(shì)件應包括:
(1). 發(fā)生在本中心的嚴重不良事(shì)件,24小時(shí)内遞交嚴重不良事(shì)件報告表原件;
(2). 發(fā)生在其他中心的嚴重不良事(shì)件,向(xiàng)倫理委員會(huì)提交《嚴重不良事(shì)件報告表》副本;
(3). 使用倫理委員會(huì)提供的樣(yàng)本或與樣(yàng)本内容一緻的報告表;
(4). 發(fā)生在本中心的嚴重不良事(shì)件,提供向(xiàng)國(guó)家藥監局和省藥監局備案的回執;
(5). 報告時(shí)還(hái)應說(shuō)明研究者或申辦者是否計劃或已經(jīng)修改研究方案或修改知情同意書,如需修改請注明理由,修改需在得到(dào)倫理委員會(huì)批準後(hòu)方可實施。
4)年度/定期跟蹤審查應包括:
(1). 遞交信(含遞交文件清單、注明版本号和日期)
(2). 年度/定期跟蹤審查報告
(3). 有簽名的正在使用的知情同意書複印件一份(由IEC批準的最終版本)
5)研究方案結題後(hòu)申請審查應包括:
(1). 遞交信(含遞交文件清單、注明版本号和日期)
(2). 結題報告
6)提前終止試驗應包括:
(1). 遞交信(含遞交文件清單、注明版本号和日期)
(2). 暫停提前終止研究報告
2.2.2. 年度/定期持續審查:
根據倫理審查批件或意見規定的年度/定期跟蹤審查頻率,在截止日期前1個月提交研究進(jìn)展報告;申辦者應當向(xiàng)組長(cháng)單位倫理委員會(huì)提交各中心研究進(jìn)展的彙總報告;當出現任何可能(néng)顯著影響研究進(jìn)行或增加受試者危險的情況時(shí),應以“研究進(jìn)展報告”的方式,及時(shí)報倫理委員會(huì)審查。如果倫理審查批件下發(fā)滿一年,而項目沒(méi)有啟動,需重新提交倫理申請并獲得批準後(hòu)方可實施。
2.2.3. 嚴重不良事(shì)件報告:
嚴重不良事(shì)件是指臨床研究過(guò)程中發(fā)生需住院治療、延長(cháng)住院時(shí)間、傷殘、影響工作能(néng)力、危及生命或死亡、導緻先天畸形等事(shì)件。發(fā)生嚴重不良事(shì)件,應在獲知24小時(shí)内向(xiàng)倫理委員會(huì)報告。
2.2.4. 違背方案審查:
1) 嚴重違背方案:
研究納入了不符合納入标準或符合排除标準的受試者,符合中止試驗規定而未讓受試者退出研究,給予錯誤治療或劑量,給予方案禁止的合并用藥等沒(méi)有遵從方案開(kāi)展研究的情況;或可能(néng)對(duì)受試者的權益/健康以及研究的科學(xué)性造成(chéng)顯著影響等違背GCP原則的情況。
2) 持續違背方案,或研究者不配合監查稽查,或對(duì)違規事(shì)件不予以糾正。
凡是發(fā)生上述研究者違背GCP原則、沒(méi)有遵從方案開(kāi)展研究,可能(néng)對(duì)受試者的權益,健康以及研究的科學(xué)性造成(chéng)顯著影響的情況,應提交違背方案報告。為避免研究對(duì)受試者的即刻危險,研究者可在倫理委員會(huì)批準前偏離研究方案,事(shì)後(hòu)應以“違背方案報告”的方式,向(xiàng)倫理委員會(huì)報告任何偏離已批準方案之處并作解釋。
2.2.5. 暫停/終止研究審查:
研究者/申辦者暫停或提前終止臨床研究,應及時(shí)向(xiàng)倫理委員提交暫停/終止研究報告。
2.2.6. 結題審查:完成(chéng)臨床研究,應及時(shí)向(xiàng)倫理委員會(huì)提交結題報告。
2.3. 複審
初始審查和跟蹤審查後(hòu),按倫理審查意見“作必要的修正後(hòu)同意”、“作必要的修正後(hòu)重審”,對(duì)方案進(jìn)行修改後(hòu),再次送審,經(jīng)倫理委員會(huì)批準後(hòu)方可實施。
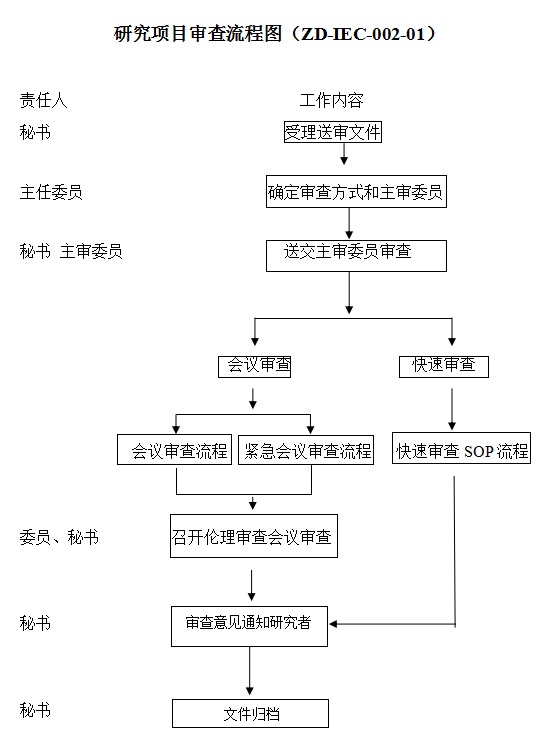
3.提交倫理審查的流程
3.1 提交送審文件
3.1.1. 準備送審文件:根據送審文件清單,準備送審文件。
3.1.2. 填寫申請/報告的表格:根據倫理審查申請/報告的類别,填寫相應的“申請” (初始審查申請,修正案審查申請,複審申請),或“報告”(年度/定期持續審查報告,嚴重不良事(shì)件/非預期不良事(shì)件報告,違背方案報告,暫停/終止研究報告,結題報告)。
3.1.3. 初始審查:填寫《初始審查申請表》,并按照《初始審查遞交資料清單》資料要求,統一使用文件夾,準備全套紙質資料一式一份,并蓋章齊全後(hòu)送至倫理辦。特别注意:①臨床研究方案需要有申辦者和研究者雙方簽字的方案簽字頁。②知情同意書需要加上“藥物臨床試驗倫理委員會(huì)聯系人:孫雪松,韓玉玲,聯系電話:0352-5556221”。通過(guò)形式審查後(hòu),再準備全套書面(miàn)送審材料5份送至倫理委員會(huì)辦公室,以及全套資料的電子文件發(fā)送至倫理委員會(huì)辦公室電子郵箱:sxdtgcp@sohu.com。
3.1.4. 通過(guò)形式審查後(hòu),將(jiāng)倫理審查費用打款至我院醫院賬戶。
3.1.5. 倫理審查會(huì)上會(huì)前,將(jiāng)幻燈做好(hǎo)發(fā)送至倫理辦電子郵箱:sxdtgcp@sohu.com。如有任何更改,需告知再次存檔。注意:幻燈應簡潔(約10分鐘左右),重點應突出(研究背景不宜過(guò)多,I、Ⅱ、Ⅲ期試驗研究情況盡量不講),重點講此次四期臨床試驗的研究目的、試驗方案、試驗流程、知情同意等。
3.1.6. 倫理上會(huì)前應對(duì)主要研究者進(jìn)行培訓。上會(huì)時(shí)彙報幻燈十分鐘,然後(hòu)對(duì)各委員提出的問題答疑。
3.1.7. 确定上會(huì)時(shí)間後(hòu),若彙報者不能(néng)準時(shí)到(dào)場,該項目審查時(shí)間自動推遲到(dào)下一次倫理會(huì)。
3.1.8.上述資料未經(jīng)本委員會(huì)批準,不得作任何修改;如臨床試驗方案、知情同意書及研究者等有任何更改,應及時(shí)通知倫理委員會(huì),得到(dào)重新批準;
3.2 補充/修改送審材料通知:倫理委員會(huì)辦公室受理後(hòu),如果認為送審文件有缺失,通知申請人補齊相關項目。
3.3 接受審查的準備
3.3.1. 會(huì)議時(shí)間,地點:辦公室秘書電話通知。
3.3.2. 準備會(huì)議報告:按照通知,需要到(dào)會(huì)報告者,準備報告内容,提前15分鐘到(dào)達會(huì)場。
4. 倫理審查的時(shí)間
倫理委員會(huì)按需召開(kāi),緊急會(huì)議及時(shí)召開(kāi)。倫理委員會(huì)辦公室受理送審文件後(hòu),一般需要1周的時(shí)間進(jìn)行處理,請在會(huì)議審查l周前提交送審文件。
研究過(guò)程中出現重大或嚴重問題,危及受試者安全時(shí),或發(fā)生其它需要倫理委員會(huì)召開(kāi)會(huì)議進(jìn)行緊急審查和決定的情況,倫理委員會(huì)將(jiāng)召開(kāi)緊急會(huì)議進(jìn)行審查。
5. 審查決定的傳達
倫理委員會(huì)對(duì)審查的研究項目作出批準、不批準、修改後(hòu)批準、修改後(hòu)再審、暫停或終止決定的決定,并說(shuō)明理由,并在做出倫理審查決定後(hòu)5個工作日内,以“倫理審查批件”或“倫理審查意見”的書面(miàn)方式傳達審查決定。
6. 倫理審查的費用
國(guó)際多中心臨床試驗按常規審查費用5000元/項·次收取,國(guó)内多中心臨床試驗按常規審查費用4000元/項·次收取。修正案審查按2000元/項·次收取。
7. 聯系方式
倫理委員會(huì)辦公室電話:0352-5556185
聯系人:孫雪松 韓玉玲
Email:sxdtgcp@sohu.com
8. 倫理審查批件
倫理審查批件/倫理審查意見將(jiāng)在倫理審查會(huì)後(hòu)2周之内完成(chéng)。
9. 附件表格
1.初始審查申請表及初始審查遞交資料清單
2.修正案審查申請表
3.複審審查申請表
4.研究進(jìn)展報告
5.方案偏離/違背報告
6.暫停/終止研究報告
7.結題報告
附:藥物臨床試驗倫理審查流程(Ethics Review Flowchart):
附:倫理審查的主要内容
1. 試驗方案的設計與實施
1.1 試驗符合公認的科學(xué)原理,基于文獻以及充分的實驗室研究和動物實驗。
1.2 與試驗目的有關的試驗設計和對(duì)照組設置的合理性。
1.3 受試者提前退出試驗的标準,暫停或終止試驗的标準。
1.4 試驗實施過(guò)程中的監查和稽查計劃,包括必要時(shí)成(chéng)立獨立的數據與安全監察委員會(huì)。
1.5 研究者的資格與經(jīng)驗、并有充分的時(shí)間開(kāi)展臨床試驗,人員配備及設備條件等符合試驗要求。
1.6 臨床試驗結果報告和發(fā)表的方式。
2. 試驗的風險與受益
2.1 試驗風險的性質、程度與發(fā)生概率的評估。
2.2 風險在可能(néng)的範圍内最小化。
2.3 預期受益的評估:受試者的受益和社會(huì)的受益。
2.4 試驗風險與受益的合理性:①對(duì)受試者有直接受益前景的試驗,預期受益與風險應至少與目前可獲得的替代治療的受益與風險相當。試驗風險相對(duì)于受試者預期的受益而言必須是合理的;②對(duì)受試者沒(méi)有直接受益前景的試驗,風險相對(duì)于社會(huì)預期受益而言,必須是合理的。
3. 受試者的招募
3.1 受試者的人群特征(包括性别、年齡、種(zhǒng)族等)。
3.2 試驗的受益和風險在目标疾病人群中公平和公正分配。
3.3 拟采取的招募方式和方法。
3.4 向(xiàng)受試者或其代表告知有關試驗信息的方式。
3.5 受試者的納入與排除标準。
4. 知情同意書告知的信息
4.1 試驗目的、應遵循的試驗步驟(包括所有侵入性操作)、試驗期限。
4.2 預期的受試者的風險和不便。
4.3 預期的受益。當受試者沒(méi)有直接受益時(shí),應告知受試者。
4.4 受試者可獲得的備選治療,以及備選治療重要的潛在風險和受益。
4.5 受試者參加試驗是否獲得報酬。
4.6 受試者參加試驗是否需要承擔費用。
4.7 能(néng)識别受試者身份的有關記錄的保密程度,并說(shuō)明必要時(shí),試驗項目申辦者、倫理委員會(huì)、政府管理部門按規定可以查閱參加試驗的受試者資料。
4.8 如發(fā)生與試驗相關的損害時(shí),受試者可以獲得的治療和相應的補償。
4.9 說(shuō)明參加試驗是自願的,可以拒絕參加或有權在試驗的任何階段随時(shí)退出試驗而不會(huì)遭到(dào)歧視或報複,其醫療待遇與權益不會(huì)受到(dào)影響。
4.10 當存在有關試驗和受試者權利的問題,以及發(fā)生試驗相關傷害時(shí),有聯系人及聯系方式。
5. 知情同意的過(guò)程
5.1 知情同意應符合完全告知、充分理解、自主選擇的原則。
5.2 知情同意的表述應通俗易懂,适合該受試者群體理解的水平。
5.3 對(duì)如何獲得知情同意有詳細的描述,包括明确由誰負責獲取知情同意,以及簽署知情同意書的規定。
5.4 計劃納入不能(néng)表達知情同意者作為受試者時(shí),理由充分正當,對(duì)如何獲得知情同意或授權同意有詳細說(shuō)明。
5.5 在研究過(guò)程中聽取并答複受試者或其代表的疑問和意見的規定。
6. 受試者的醫療和保護
6.1 研究人員資格和經(jīng)驗與試驗的要求相适應。
6.2 因試驗目的而不給予标準治療的理由。
6.3 在試驗過(guò)程中和試驗結束後(hòu),為受試者提供的醫療保障。
6.4 為受試者提供适當的醫療監測、心理與社會(huì)支持。
6.5 受試者自願退出試驗時(shí)拟采取的措施。
6.6 延長(cháng)使用、緊急使用或出于同情而提供試驗用藥的标準。
6.7 試驗結束後(hòu),是否繼續向(xiàng)受試者提供試驗用藥的說(shuō)明。
6.8 受試者需要支付的費用說(shuō)明。
6.9 提供受試者的補償(包括現金、服務、和/或禮物)。
6.10 由于參加試驗造成(chéng)受試者的損害/殘疾/死亡時(shí)提供的補償或治療。
6.11 保險和損害賠償。
7. 隐私和保密
7.1 可以查閱受試者個人信息(包括病曆記錄、生物學(xué)标本)人員的規定。
7.2 确保受試者個人信息保密和安全的措施。
8. 涉及弱勢群體的試驗
8.1 唯有以該弱勢人群作為受試者,試驗才能(néng)很好(hǎo)地進(jìn)行。
8.2 試驗針對(duì)該弱勢群體特有的疾病或健康問題。
8.3 當試驗對(duì)弱勢群體受試者不提供直接受益可能(néng),試驗風險一般不得大于最小風險,除非倫理委員會(huì)同意風險程度可略有增加。
8.4 當受試者不能(néng)給予充分知情同意時(shí),要獲得其法定代理人的知情同意,如有可能(néng)還(hái)應同時(shí)獲得受試者本人的同意。
9. 涉及特殊疾病人群、特定地區人群/族群的試驗
9.1 該試驗對(duì)特殊疾病人群、特定地區人群/族群造成(chéng)的影響。
9.2 外界因素對(duì)個人知情同意的影響。
9.3 試驗過(guò)程中,計劃向(xiàng)該人群進(jìn)行咨詢。
9.4 該試驗有利于當地的發(fā)展,如加強當地的醫療保健服務,提升研究能(néng)力,以及應對(duì)公共衛生需求的能(néng)力。